2024.11.07
文献速递:瑞士科学家用人类包皮成纤维细胞培育出肺类器官!
来自伯尔尼大学的研究人员使用AVATAR Odyssey系统从诱导多能干细胞中获得了复杂的多细胞肺类器官!此项研究成果由Vedat Burak Ozan和Thomas Geiser团队在Stem Cell Reviews and Reports中发表。

诱导多能干细胞(iPSCs)可以用来做疾病建模,并促进药物筛选,近年来已逐渐成为生物医学领域很有前景的体外研究工具。研究人员已经可以将人iPSCs分化为肺细胞和三维肺球体或类器官。肺是一个多细胞的复杂器官,在微环境的交互影响下发育。
在本研究中,研究人员在可控的AVATAR微环境(cmO组,氧气和压力)中利用iPSCs制造出具备与肺泡结构复杂性相似的多细胞肺类器官。并通过SFTPC、PDPN和KRT5染色,证明存在2型和1型肺泡上皮细胞以及基底细胞。此外,cmO组中基因和蛋白表达量提高。蛋白质组学通路分析显示,与正常培养组相比,cmO组中肺发育特异性通路上调。
此项研究中,研究人员通过使用可控的微环境,建立了一个由iPSCs衍生的多细胞肺类器官,可将其作为一种新的细胞模型,用于研究肺部健康和肺泡相关疾病。
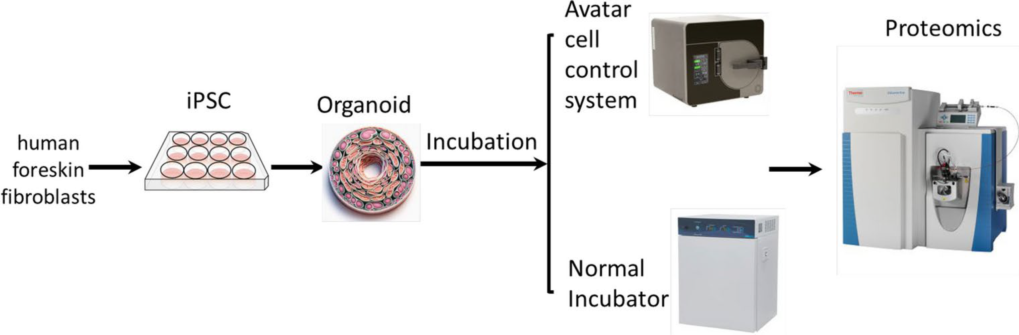
图1. 实验流程图
iPSCs分别在标准培养箱(37℃,5% CO2)和AVATAR系统中分化为成熟肺类器官。
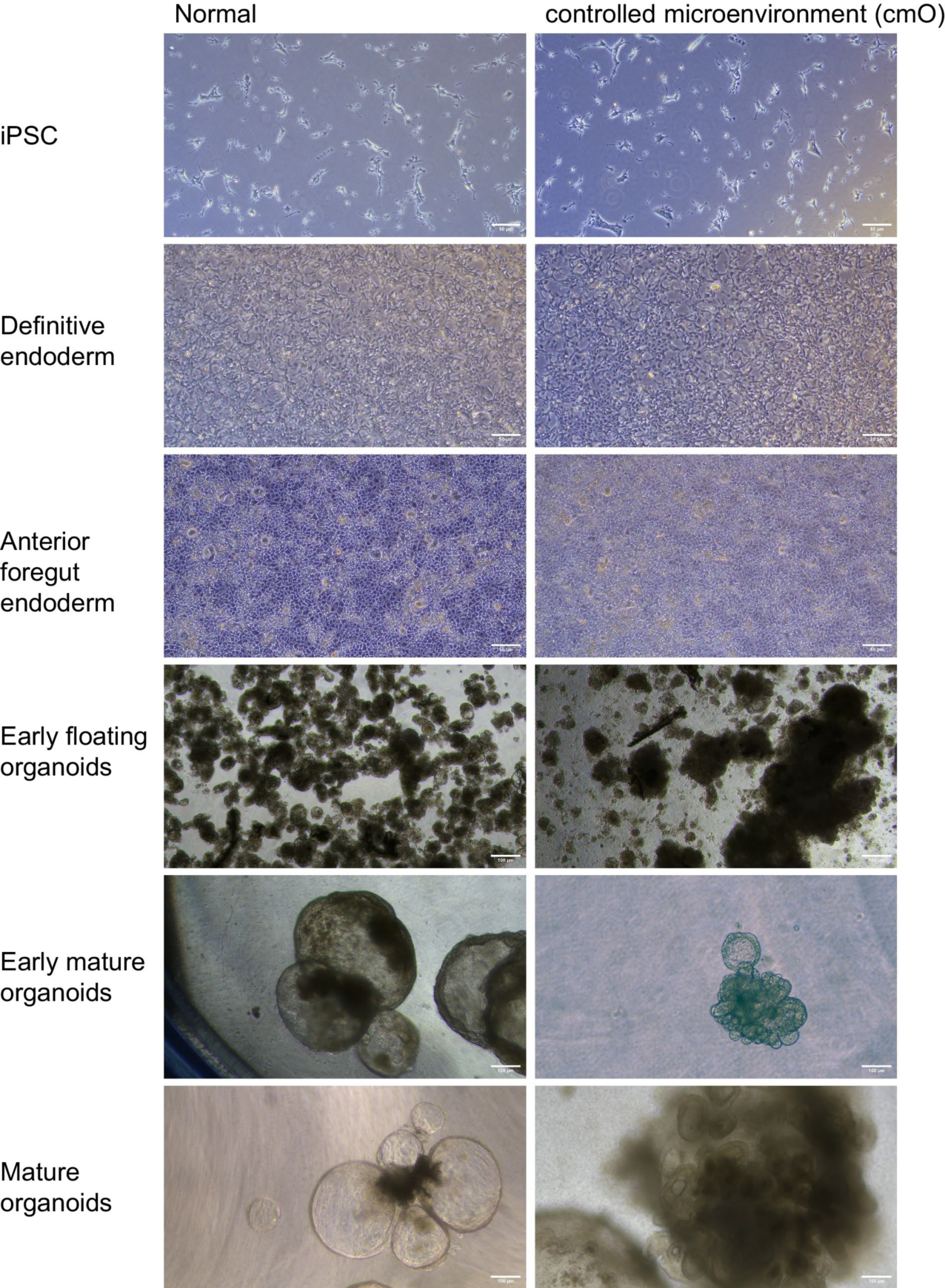
图2. 两种培养条件下,iPSCs所有分化阶段的明场图像
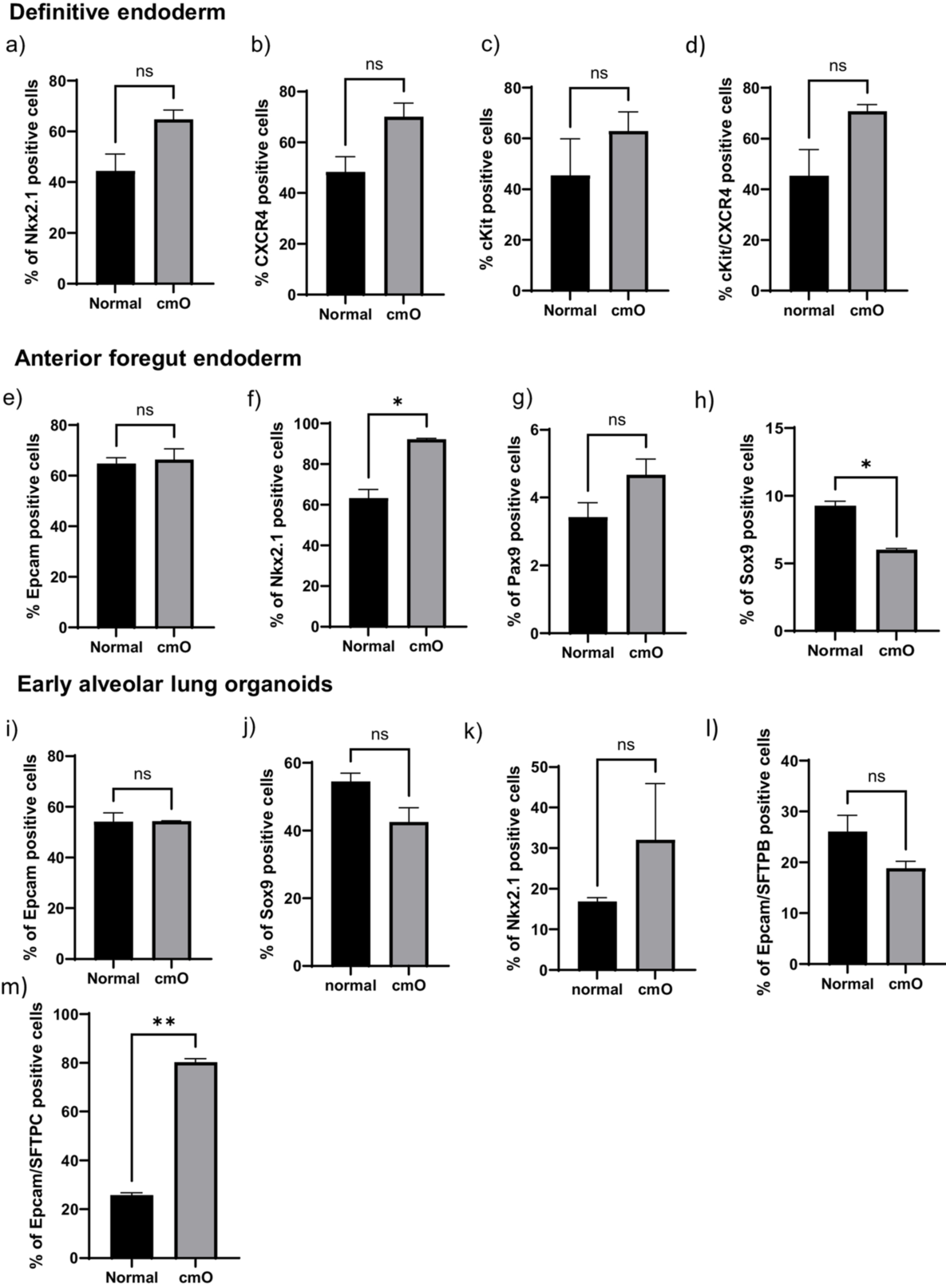
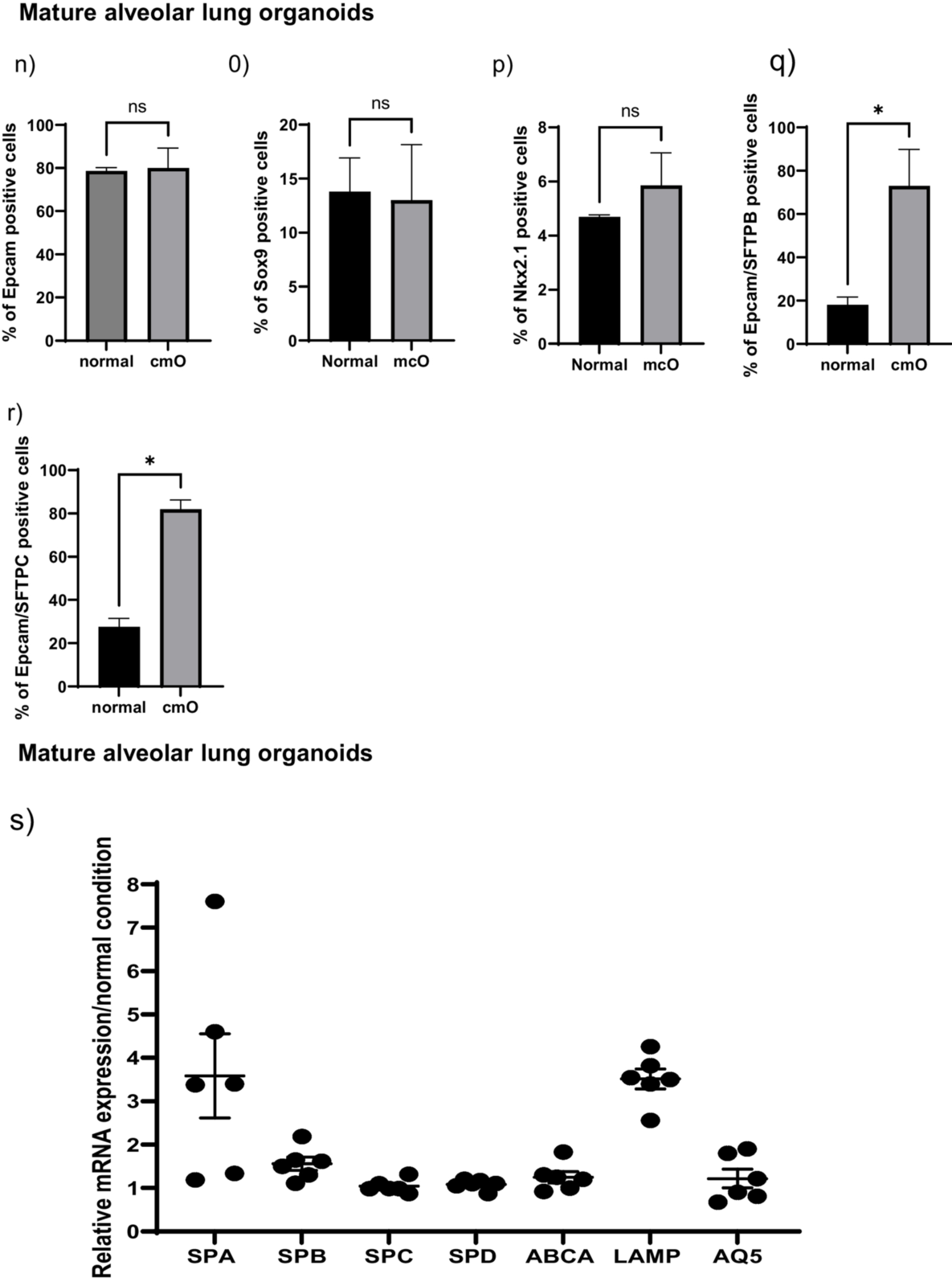
图3. 细胞表面标记物和细胞内标记物分析。通过流式细胞术分析所有阶段的细胞表面标记物和细胞内标记物的表达,数据以表达所测标记的活细胞的百分比表示,并对标准培养箱中与AVATAR系统中生长的类器官之间进行比较。
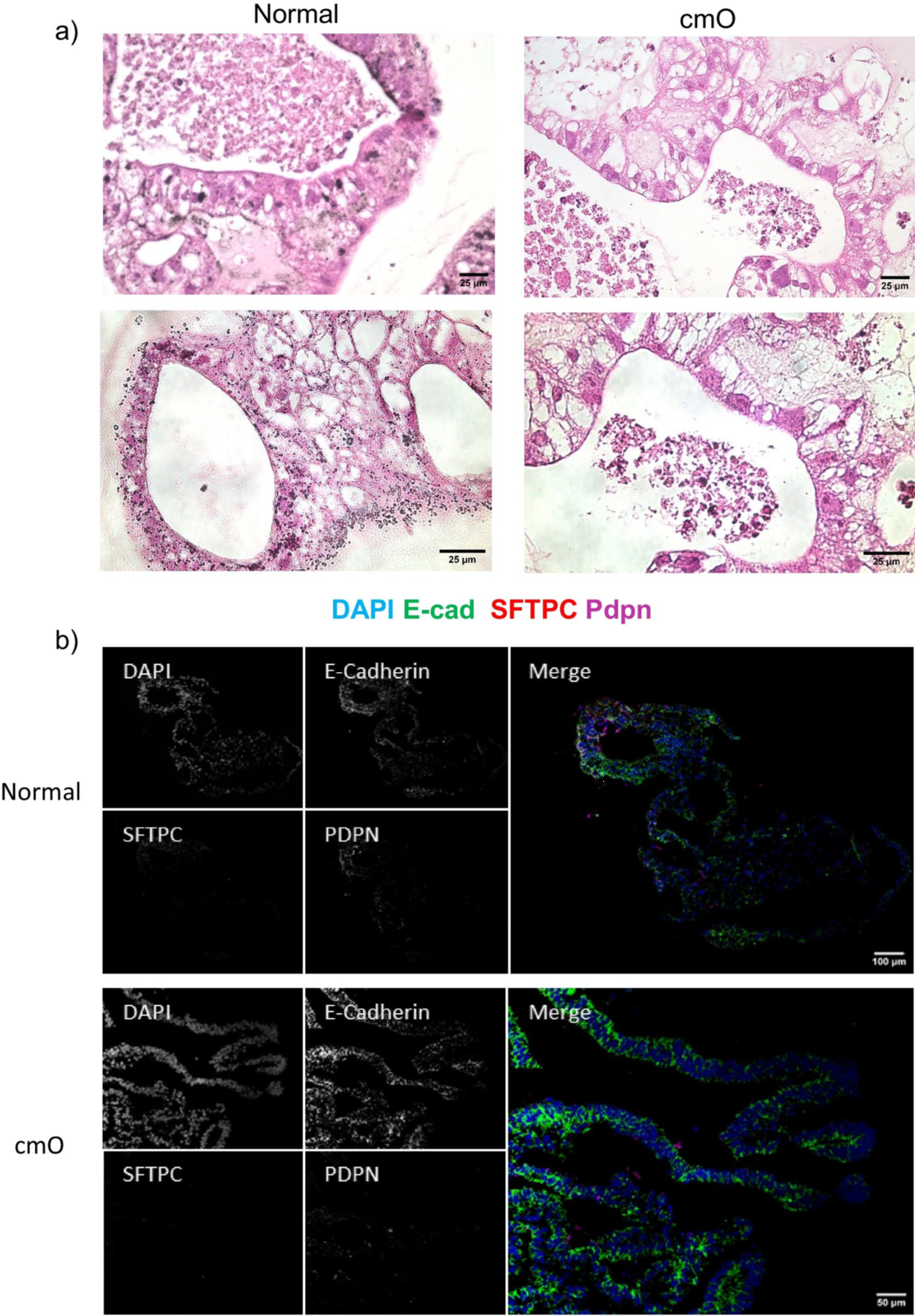
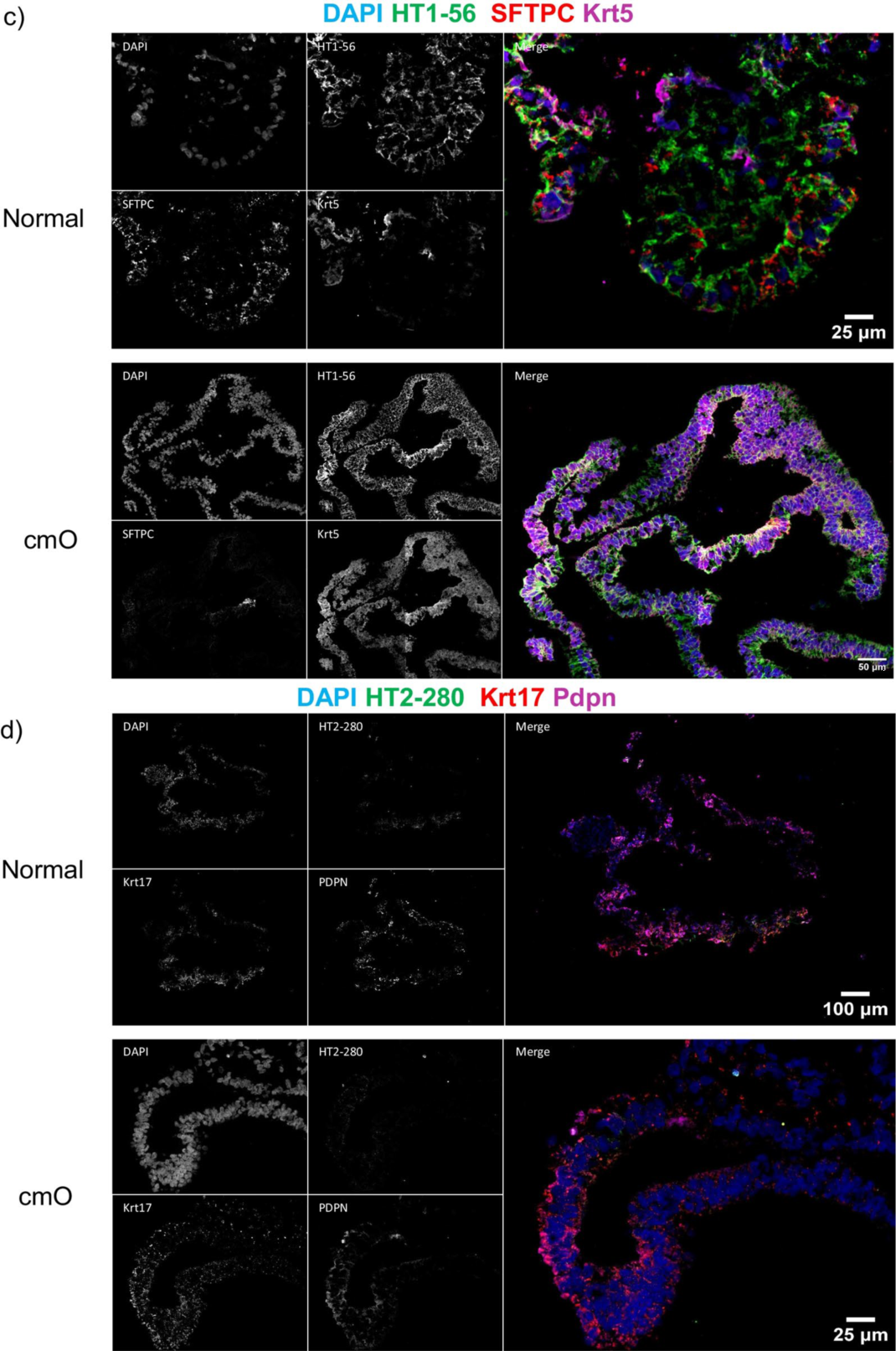
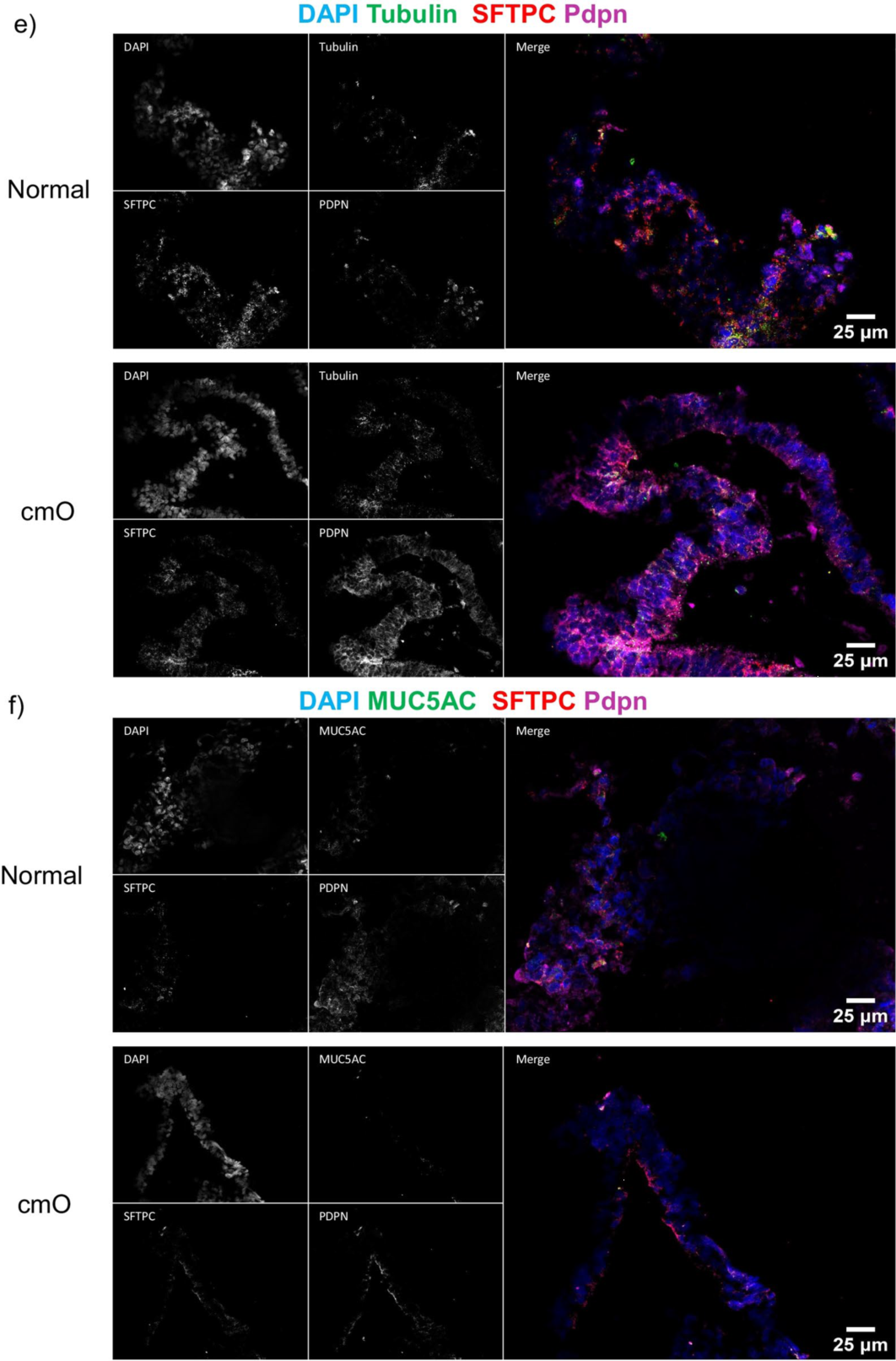
图4. 对成熟的类器官进行染色
AVATAR系统中的类器官显示出更明确的分支和细胞分布,类似于远端肺的结构,并且细胞分布的组织方式与远端肺中观察到的类似(图4a)。上皮细胞标记物SFTPC、HT1-56、HT2-280、E-cadherin、PDPN(图4b-f)的免疫染色证实了与远端肺相似的细胞分布。值得注意的是,还对AVATAR系统中的KRT 5进行了染色(图4c),显示类器官中存在基底细胞。
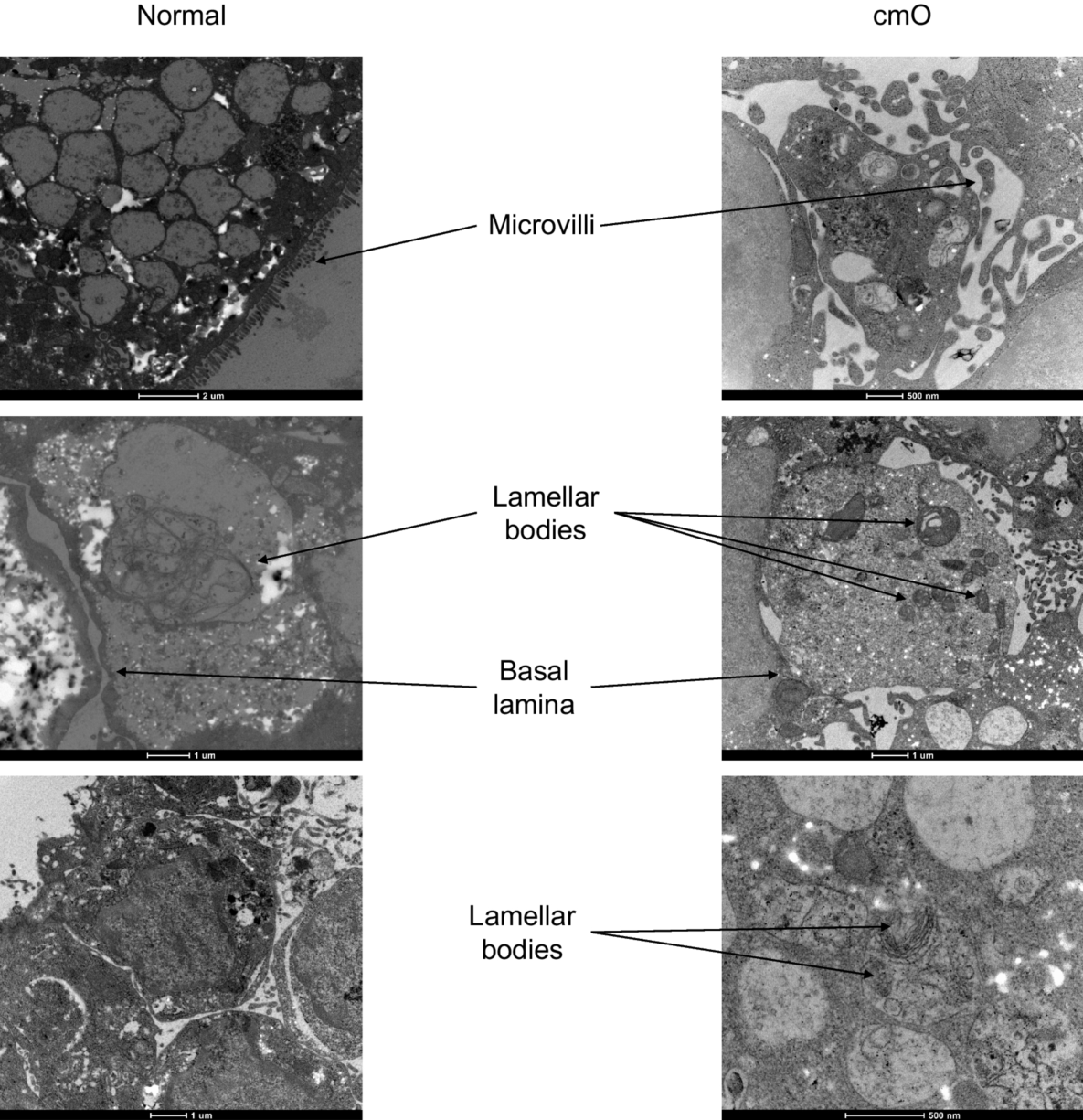
图5. 标准培养箱和AVATAR系统中培养的类器官的电子显微镜图像。标准培养箱中的类器官表现为微绒毛和疏松的板层小体,AVATAR系统中的类器官表现为微绒毛和结构良好的板层小体。
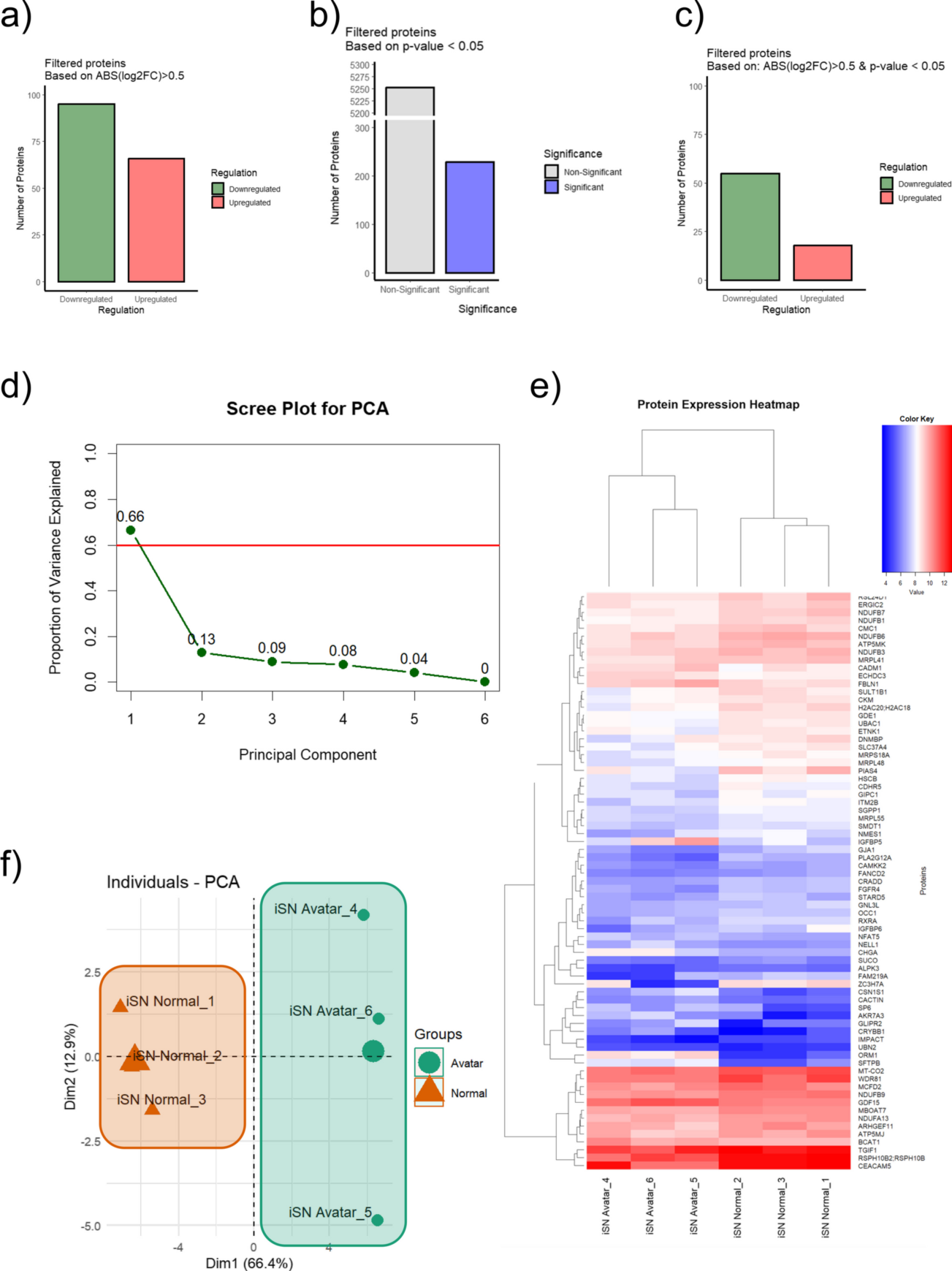
图6. (a)柱状图显示了基于绝对log2(倍数变化)> 0.5过滤的蛋白质数量,并描绘了下调和上调的蛋白质;(b)基于p值< 0.05过滤的蛋白质数量的柱状图;(c)基于绝对log2(倍数变化) > 0.5和p值< 0.05过滤的蛋白质的柱状图,根据显著性和调节分类;(d)显示PCA分析中各主成分解释的方差比例的Scree图;(e)蛋白质组学分析结果的二维PCA图,对比AVATAR系统中受控微环境(cmO)培养的类器官(绿色)和标准培养箱中培养的类器官(橙色),展示了数据中最显著变化的Dim1和Dim2的主成分分布;(f)具有层次聚类的热图,显示多个样本中蛋白质的表达模式,不同颜色键表示从低(蓝色)到高(红色)的表达水平。
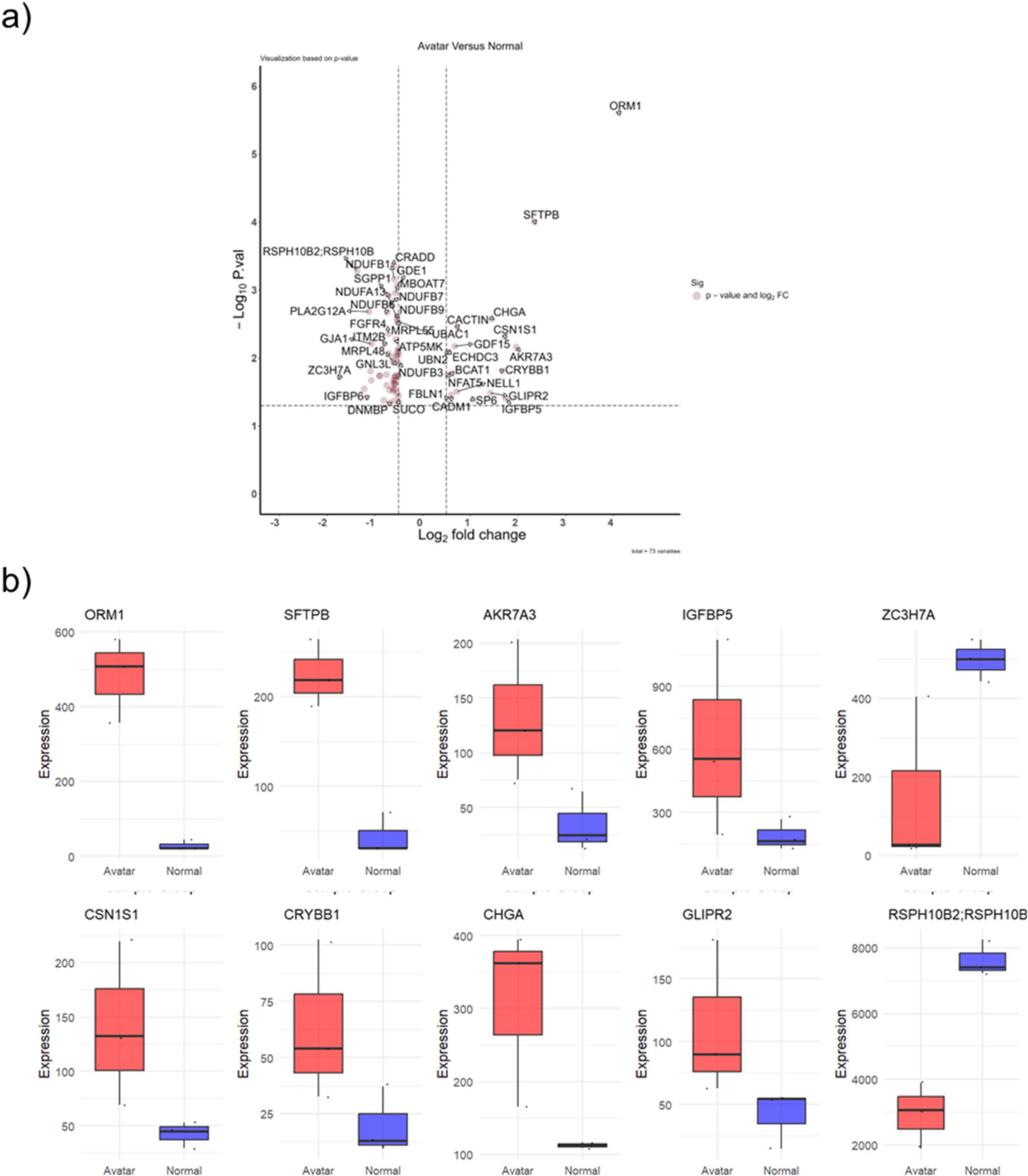
图7. 来自AVATAR系统和正常培养箱的类器官培养物的差异蛋白质表达情况。(a)显示所分析蛋白质的log2倍变化与p值的负对数的火山图,AVATAR系统中显著上调的蛋白位于右侧,显著下调的蛋白位于左侧,显著程度以y轴上的高度表示;(b)顶部差异表达蛋白的箱线图,红框表示在AVATAR系统中培养的类器官的蛋白表达水平,蓝框表示标准培养箱中培养的类器官的蛋白表达水平,每个框中的中心线代表中位表达水平,框边界表示四分位距(interquartile range, IQR)。
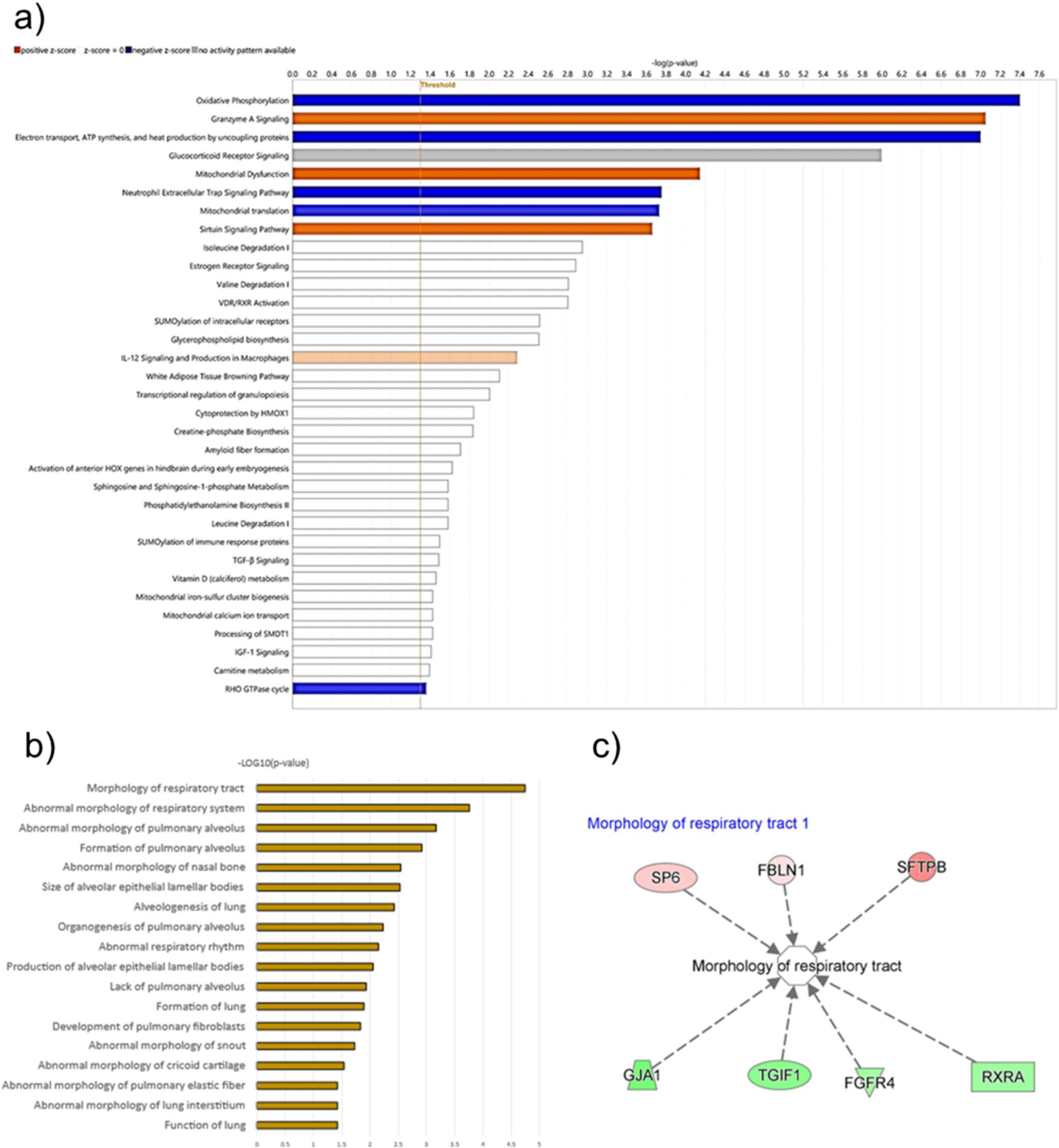
图8. 类器官培养物蛋白质组学数据的通路和功能分析。(a)利用Ingenuity Pathway analysis (IPA)工具生成的通路分析,展示了在不同条件下培养的类器官的蛋白质组学数据中富集的生物通路。通路通过-log(p-value)进行排序,阈值设置为p < 0.05,表示通路受培养条件影响的可能性。条形图的长度表示显著性水平,蓝色条形图表示预测的激活,橙色条形图表示预测的通路抑制;(b)强调与差异蛋白表达相关的疾病和生物学功能的功能分析。函数按-log(p-value)排序,阈值设为p < 0.05。条形的长度代表了组合的重要性;(c)聚焦于“呼吸道形态”功能的网络分析,在数据集中识别关键基因,根据其表达变化的方向预测影响该功能。AVATAR系统与标准培养箱相比,红色节点代表表达上调的基因,绿色节点代表表达下调的基因。
综上所述,研究人员成功地利用iPSCs制造出了肺类器官,并且在压力和氧控制的微环境中观察到肺类器官的发育和成熟,标志着肺类器官研究的一个重大飞跃。
本研究不仅强调了微环境因素在肺类器官形成中的作用,而且将这些受控的体外模型定位为研究肺发育和疾病的有效工具。可控微环境作为一个关键决定因素出现,为药物筛选、疾病建模和解开肺生理的复杂性提供了一个真实的平台,此项研究为其奠定了坚实的基础,肯定了微环境控制对体外肺类器官模型保真度的深远影响。
综上所述,研究人员成功地利用iPSCs制造出了肺类器官,并且在压力和氧控制的微环境中观察到肺类器官的发育和成熟,标志着肺类器官研究的一个重大飞跃。
本研究不仅强调了微环境因素在肺类器官形成中的作用,而且将这些受控的体外模型定位为研究肺发育和疾病的有效工具。可控微环境作为一个关键决定因素出现,为药物筛选、疾病建模和解开肺生理的复杂性提供了一个真实的平台,此项研究为其奠定了坚实的基础,肯定了微环境控制对体外肺类器官模型保真度的深远影响。




