2023.05.19
免疫反应是由多种细胞类型参与的一个受严格调控的过程,旨在保护身体免受微生物、毒素的侵害以及避免肿瘤的形成。全球各地的研究人员旨在更深入地了解这些过程,以理解癌症、自身免疫性疾病、炎症、过敏和病毒感染背后的机制。实时活细胞动态成像技术正是一种为此提供全面数据的宝贵工具。
本文中,我们使用了新一代活细胞成像系统CELLCYTE X来解决免疫学中的不同问题:观察不同类型免疫细胞的形态和增殖状态,记录巨噬细胞分化过程中的生长行为,进一步讨论了CELLCYTE X如何用于分析细胞死亡期间的免疫细胞健康状况(一种防止免疫系统过度反应的反馈机制),以及利用它来评估细胞免疫疗法(如CAR- T疗法),以根除癌症细胞,从而为免疫学研究提供有效的解决方法。
 新一代活细胞成像系统 CELLCYTE X
新一代活细胞成像系统 CELLCYTE X
材料与方法
1. 细胞培养
将Jurkat、Nalm-6和THP-1细胞在有10%胎牛血清(FBS)(Sigma)和1%青霉素/链霉素(P/S)(Thermo Fisher)的RPMI-1640培养基(Thermo Fisher)中,在37°C和5%CO2下培养。每周传代两次,接种用于如下所述研究。
2. 免疫细胞增值研究
将Jurkat、Nalm-6和THP-1细胞重悬、计数并以所示细胞数(2.5k、5k、10k、20k、40k/孔)接种在96孔细胞培养板(Corning,#3595)中。细胞在室温下沉淀30min,以确保细胞在整个孔中均匀分布。随后,将细胞培养板置于培养箱中的CELLCYTE X中观测。使用10X镜头标准扫描模块每2小时扫描一次,监测细胞生长持续96小时。使用CELLCYTE Studio中的细胞融合模块分析细胞生长情况(图1)。
3. 巨噬细胞分化研究
将THP-1单核细胞重悬、计数并以每孔10k个细胞接种在96孔细胞培养板中。将12-myristate 13-acetate (PMA) (PeproTech) 以1mg/mL溶解在DMSO中,并将其添加到孔中以获得5ng/mL、50ng/mL或500ng/mL的最终浓度。浓度为2.5µg/µL 的Lipopolysaccharide(LPS)(Thermo Fisher)作为即用溶液添加到细胞中,以在孔中获得10ng/µL、100ng/µL.或1000ng/µL的最终浓度。对照细胞不做处理。使用10X标准扫描模块每3小时对细胞成像,持续96小时。使用CELLCYTE Studio中的细胞融合模块分析细胞生长情况(图2)。
4. 活化诱导的细胞死亡研究
将Jurkat细胞重悬、计数并以每孔10k个细胞接种在96孔细胞培养板中。加入C.LIVE Tox Green(1 mM in DMSO)(CYTENA,CY.CL.KIT.002,此染料只能进入失去膜完整性的死细胞,当它与DNA结合时会发出绿色荧光,从而提供有价值的细胞死亡实时读数)以在孔中获得250nM的最终浓度。将Ionomycin (Cayman)溶于DMSO中以获得1mg/mL的储备浓度。Jurkat细胞在有或无10ng/mL PMA和750ng/mL Ionomycin (1X)或其稀释液(0.5X,0.25X,0.125X,0.0625X)的组合下生长。使用CELLCYTE X 10X标准扫描模块每3小时监测一次Jurkat细胞的生长和健康状况,持续96小时,并对融合与绿色荧光计数进行量化(图3)。
5. 细胞免疫疗法研究
此细胞免疫疗法研究与弗赖堡大学CIBSS与BIOSS研究中心的Susana Minguet博士研究小组合作进行。将Nalm-6细胞重悬、计数并以每孔20k个细胞接种在96孔细胞培养板中。将CYTENA的C.LIVE Caspase-3 Green NucView(5 mM,溶解在DMSO中)添加到细胞中,在孔中获得2.5µM的最终浓度。CAR-T细胞的产生如下文所述。将CAR-T细胞以1:1或3:1的效靶比添加到Nalm-6细胞中,并使用10X标准扫描模块的CELLCYTE X每小时监测共培养,持续12小时。使用CELLCYTE Studio中的目标对象计数模块对C.LIVE Caspase-3的总强度进行量化。
实验结果
1. 免疫细胞生长和增殖
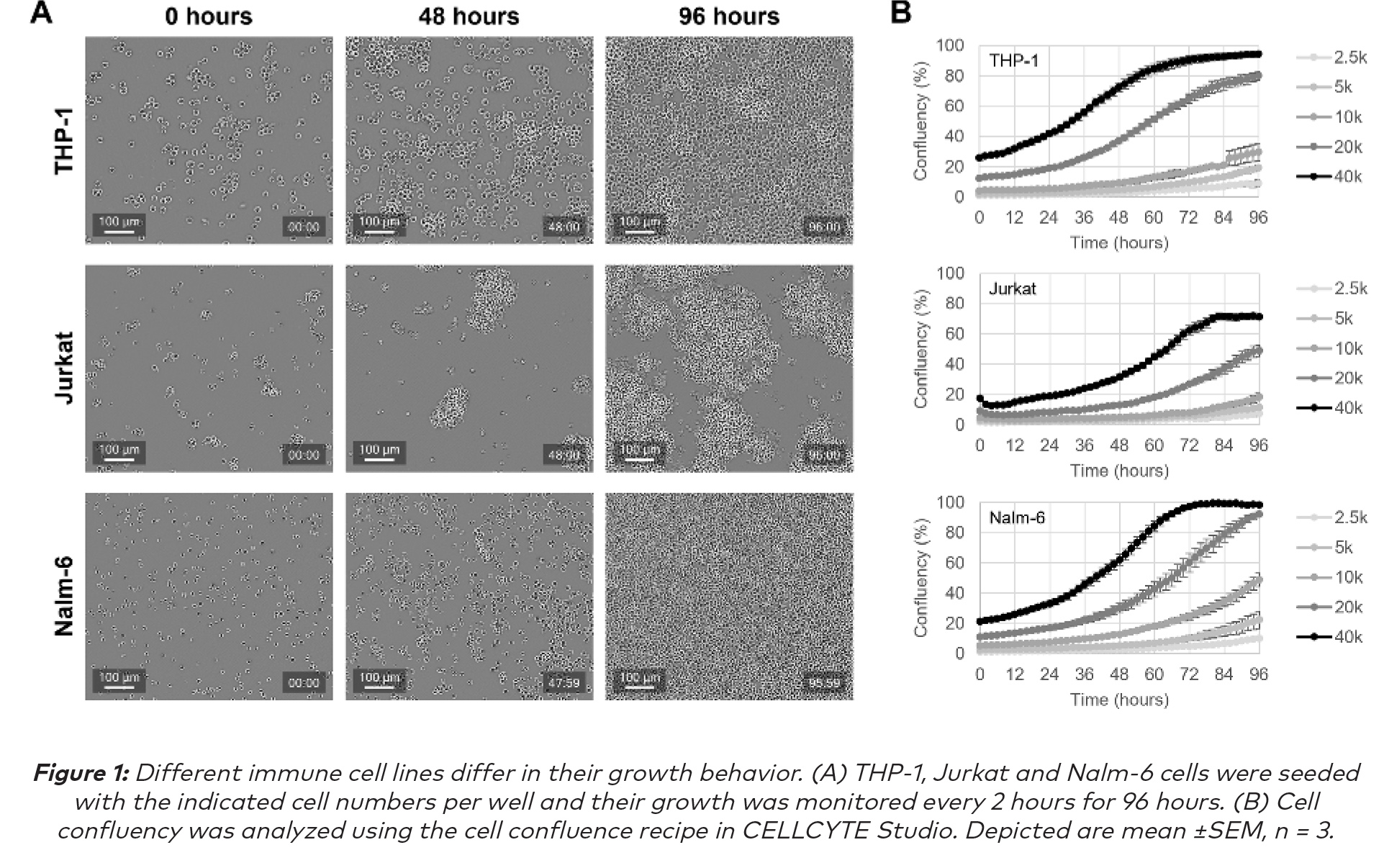 来自CELLCYTE X的增强轮廓图像显示:THP-1细胞体积比其他免疫细胞系相对较大,并且在细胞悬液中它们往往以单细胞的形式生长。Jurkat细胞相对较小,主要以悬浮细胞簇的形式生长。Nalm-6细胞的细胞大小与Jurkat细胞大致相同,但在悬浮液中以单细胞形式生长(图1A)。这些观察结果已在文献中得到证实(1)。随着时间的推移,三种细胞系的生长被量化并显示出稳定增殖(图1B)。和预期的一样,播种密度更高的孔更快达到完全汇合。此外,还注意到Jurkat细胞在观察到的时间范围内没有达到完全融合,这是因为它们是作为细胞簇生长。总之,CELLCYTE X及其可靠的自动聚焦可以对悬浮液中不同生长形态的免疫细胞连续成像,实时分析细胞增殖,提供细胞生长的全面数据。
来自CELLCYTE X的增强轮廓图像显示:THP-1细胞体积比其他免疫细胞系相对较大,并且在细胞悬液中它们往往以单细胞的形式生长。Jurkat细胞相对较小,主要以悬浮细胞簇的形式生长。Nalm-6细胞的细胞大小与Jurkat细胞大致相同,但在悬浮液中以单细胞形式生长(图1A)。这些观察结果已在文献中得到证实(1)。随着时间的推移,三种细胞系的生长被量化并显示出稳定增殖(图1B)。和预期的一样,播种密度更高的孔更快达到完全汇合。此外,还注意到Jurkat细胞在观察到的时间范围内没有达到完全融合,这是因为它们是作为细胞簇生长。总之,CELLCYTE X及其可靠的自动聚焦可以对悬浮液中不同生长形态的免疫细胞连续成像,实时分析细胞增殖,提供细胞生长的全面数据。
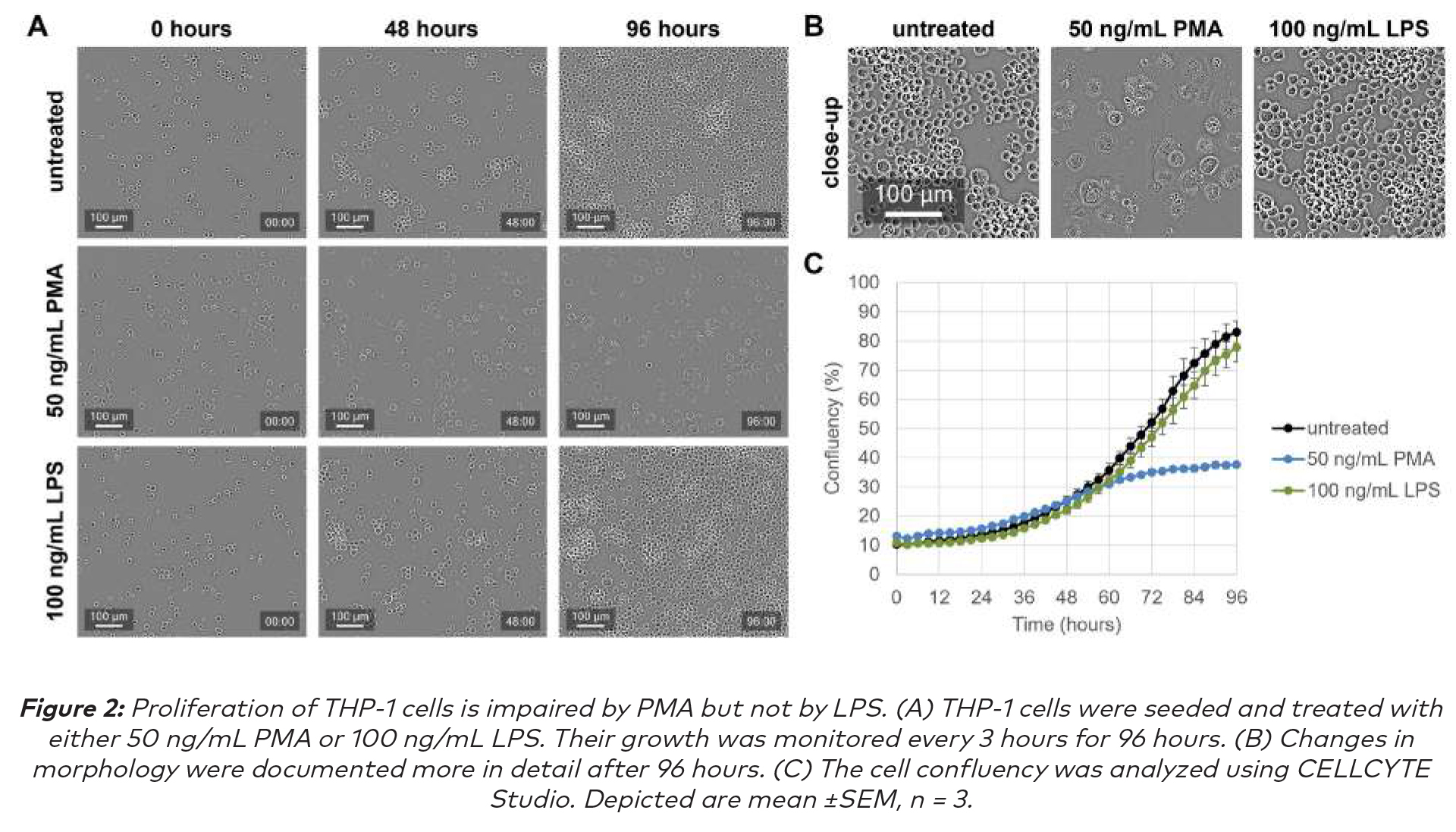 来自CELLCYTE Studio中的细胞融合模块分析显示:随着时间的推移PMA处理的THP-1细胞改变了它们的形态,细胞质体积显著增加导致了细胞体积增大,并且细胞也开始粘附在细胞培养板上(图2A和B),在此观察到的变化与巨噬细胞分化与核质比率降低和细胞粘附增加相关的研究一致(2,3)。此外,与未经处理的对照细胞相比,随着时间的推移细胞融合减少,表明细胞增殖减少(图2C)。
来自CELLCYTE Studio中的细胞融合模块分析显示:随着时间的推移PMA处理的THP-1细胞改变了它们的形态,细胞质体积显著增加导致了细胞体积增大,并且细胞也开始粘附在细胞培养板上(图2A和B),在此观察到的变化与巨噬细胞分化与核质比率降低和细胞粘附增加相关的研究一致(2,3)。此外,与未经处理的对照细胞相比,随着时间的推移细胞融合减少,表明细胞增殖减少(图2C)。
CELLCYTE X允许对分化过程进行全面的理解,因为在量化融合的同时提供视觉洞察力。它通过剧烈的形态学变化来跟踪整个过程,从而准确测量免疫细胞对不同刺激的反应。LPS刺激THP-1细胞不会导致形态变化(图2A和B),也不会影响细胞增殖(图2C)。这一观察结果得到了文献的证实(4,5)。
3. 激活诱导的细胞死亡
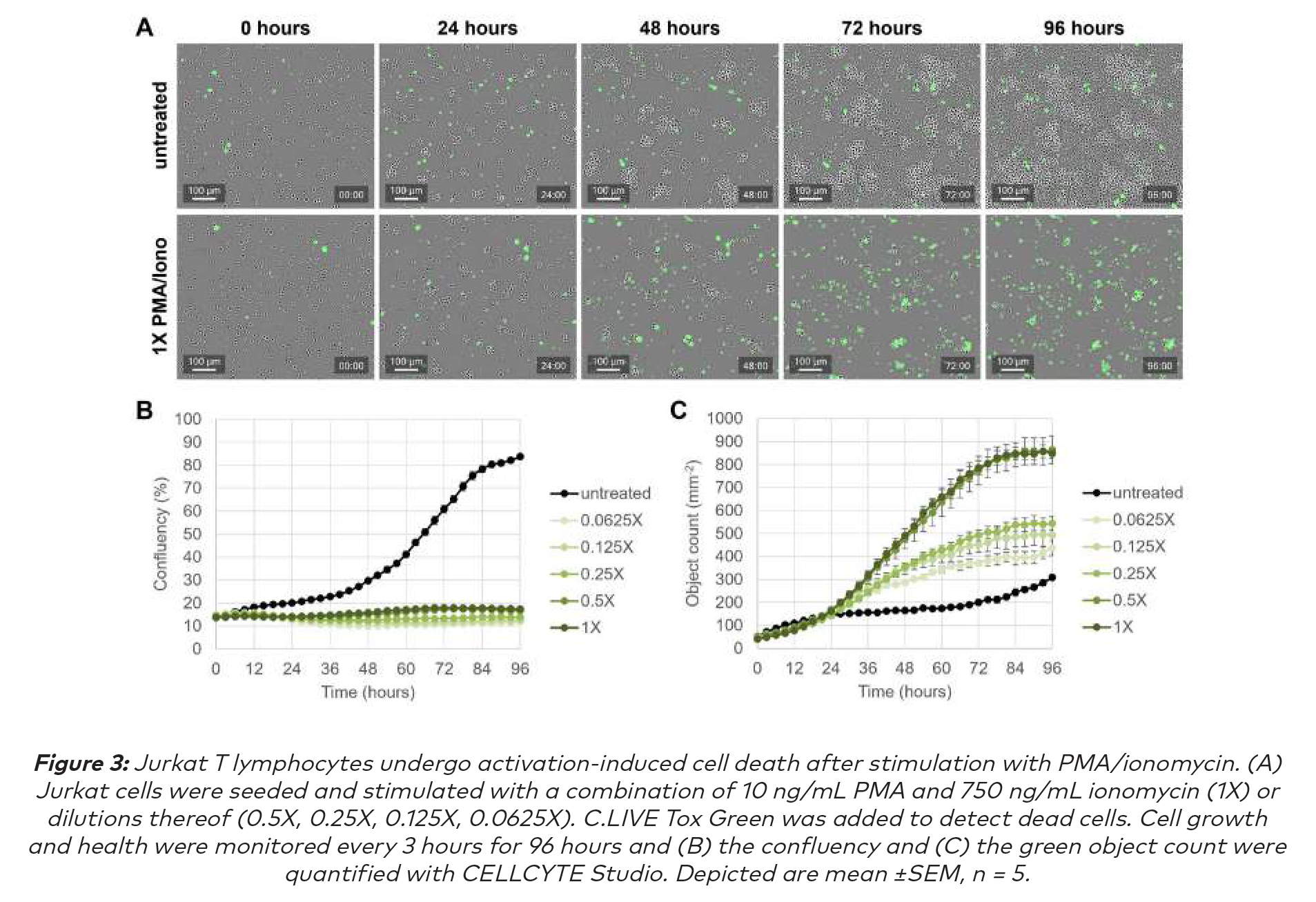 CELLCYTE X 成像显示:在96小时的过程中,用PMA和离子霉素的组合刺激显著减少了细胞增殖,未经处理的对照细胞随着时间的推移显示出预期的汇合(图3A和B)。此外,PMA/离子霉素处理的细胞显示出死亡细胞的增加,这种效应可以以剂量依赖的方式观察到。对照细胞仅显示出少量的细胞死亡,尤其是在细胞高度融合的后期(图3C)。这些观察结果表明,用PMA和离子霉素治疗确实会引发活性诱导的细胞死亡(AICD),正如之前的其他研究所表明的那样,这些研究认为PMA可以激活蛋白激酶C,而钙离子载体离子霉素可以提高细胞内Ca2+水平,从而导致数种模拟TCR激活的细胞内信号通路的激活,并导致AICD。(6)
CELLCYTE X 成像显示:在96小时的过程中,用PMA和离子霉素的组合刺激显著减少了细胞增殖,未经处理的对照细胞随着时间的推移显示出预期的汇合(图3A和B)。此外,PMA/离子霉素处理的细胞显示出死亡细胞的增加,这种效应可以以剂量依赖的方式观察到。对照细胞仅显示出少量的细胞死亡,尤其是在细胞高度融合的后期(图3C)。这些观察结果表明,用PMA和离子霉素治疗确实会引发活性诱导的细胞死亡(AICD),正如之前的其他研究所表明的那样,这些研究认为PMA可以激活蛋白激酶C,而钙离子载体离子霉素可以提高细胞内Ca2+水平,从而导致数种模拟TCR激活的细胞内信号通路的激活,并导致AICD。(6)
在此项研究中,CELLCYTE X促进了动态量化,可以实时检测治疗效果。CYTENA的C.LIVE Tox试剂允许在AICD过程中直接检测死细胞。除了自动图像分析之外,用户还可以通过基于图像的方法监测细胞形态,以获得细胞死亡过程的详细见解。
4. 激活诱导的细胞死亡
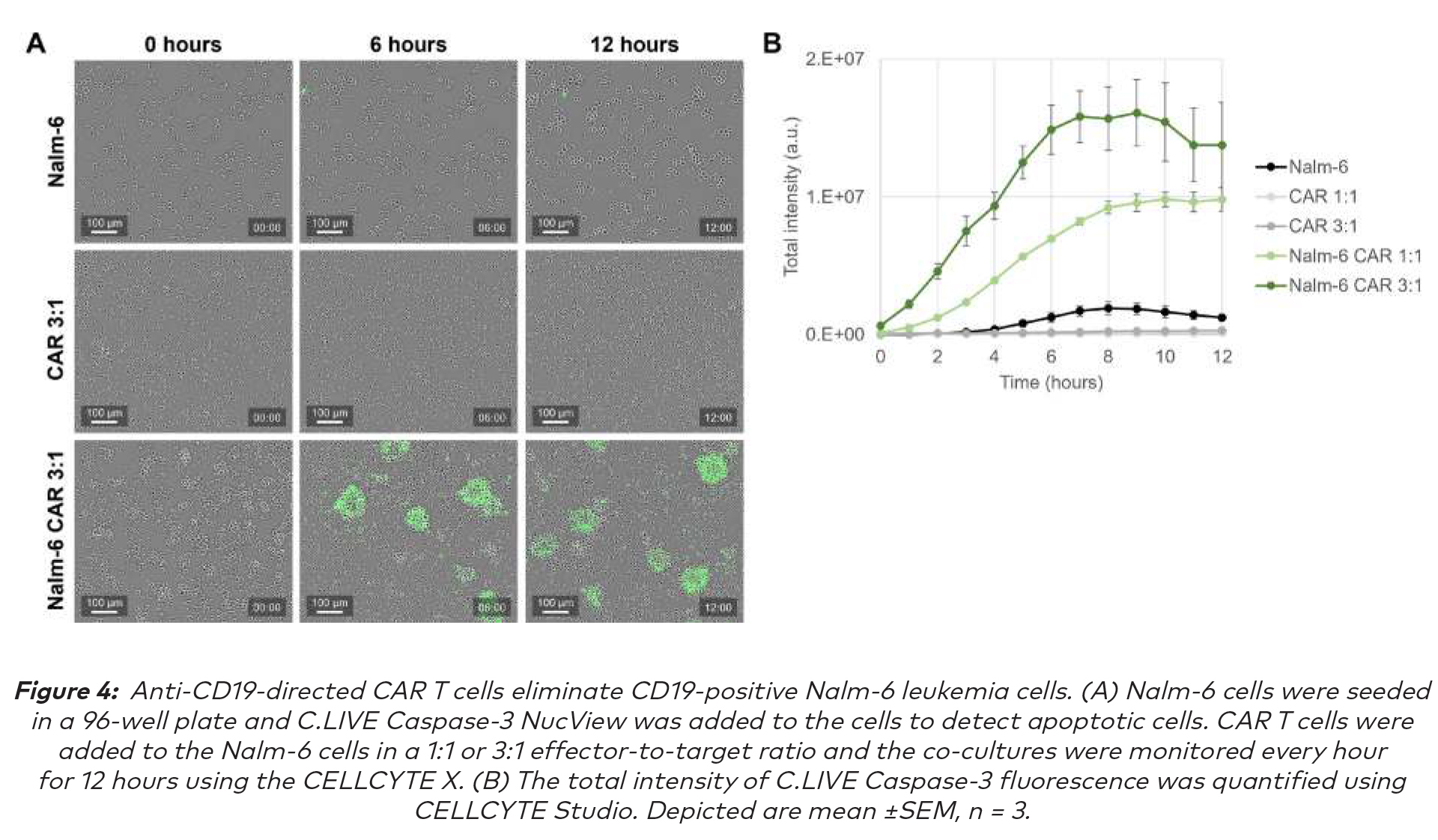 绿色C.LIVE Caspase-3染料总荧光强度显示,单独培养的Nalm-6靶细胞和CAR-T效应细胞以单细胞形式生长,且只有少量细胞发生凋亡。相反,Nalm-6细胞和CAR-T细胞的共培养产生细胞簇,并在12小时的时间过程中显示出绿色总荧光强度的显著增加,这表明CAR-T细胞可以识别并杀死Nalm-6细胞。
绿色C.LIVE Caspase-3染料总荧光强度显示,单独培养的Nalm-6靶细胞和CAR-T效应细胞以单细胞形式生长,且只有少量细胞发生凋亡。相反,Nalm-6细胞和CAR-T细胞的共培养产生细胞簇,并在12小时的时间过程中显示出绿色总荧光强度的显著增加,这表明CAR-T细胞可以识别并杀死Nalm-6细胞。
使用CELLCYTE X能够对杀伤过程进行详细的动态监测。观察到的杀伤效果取决于效应细胞与靶细胞的比例,这是由于更高数量CAR-T细胞显示出更高的总荧光强度,这表明靶细胞的杀伤更有效、更早。此外,每小时扫描可以全面实时记录这些快速免疫细胞杀伤过程。用CELLCYTE X进行的观察结果与将CD19导向的CAR - T细胞治疗B细胞恶性肿瘤非常有效的研究相一致。(7)
活细胞成像技术在免疫学应用中的优势
德国Cytena开发的CELLCYTE X 新一代活细胞实时动态成像及功能分析系统可内置在任何品牌型号的CO2培养箱中,对正常培养中的细胞做长时间实时24小时循环拍摄成像,监测细胞的生长变化状态,并对其进行功能分析,输出随时间变化曲线、各个时间点图片、过程影像等数据结果。在免疫学应用中,它有以下优势:
自带强大的自动聚焦算法能够连续跟踪不同生长形态的悬浮液中生长的各种免疫细胞。
使用自动活细胞成像平台捕捉免疫反应的快速动力学。
CELLCYTE X的分析软件提供多功能和高度特异性的读数,记录免疫细胞生长和健康、巨噬细胞分化和T细胞杀伤分析中的反应。
通过定性形态学研究和定量测量,对不同刺激的免疫反应进行综合评估。
参考文献
1. Components of the Immune System. Primer to the Immune Response. Elsevier; 2014: 21-54. DOI:10.1016/B978-0-12-385245-8.00002-9
2. Daigneault M, Preston JA, Marriott HM, et al. The identification of markers of macrophage differentiation in PMA-stimulated THP-1 cells and monocyte-derived macrophages. PLoS ONE. 2010; 5(1): e8668. DOI:10.1371/journal.pone.0008668
3. 1Pinto SM, Kim H, Subbannayya Y, et al. Comparative proteomic analysis reveals varying impact on immune responses in phorbol 12-myristate-13-acetate-mediated THP-1 monocyte-to-macrophage differentiation. Frontiers in Immunology. 2021; 12. DOI:10.3389/fimmu.2021.679458
4. Widdrington JD, Gomez-Duran A, Pyle A, et al. Exposure of monocytic cells to lipopolysaccharide induces coordinated endotoxin tolerance, mitochondrial biogenesis, mitophagy, and antioxidant defenses. Frontiers in Immunology. 2018; 9. DOI:10.3389/fimmu.2018.02217
5. Tucureanu MM, Rebleanu D, Constantinescu CA, et al. Lipopolysaccharide-induced inflammation in monocytes/macrophages is blocked by liposomal delivery of Gi-protein inhibitor. International Journal of Nanomedicine. 2018; 13: 63-76. DOI:10.2147/IJN.S150918
6. Ai W, Li H, Song N, Li L, Chen H. Optimal method to stimulate cytokine production and its use in immunotoxicity assessment. International Journal of Environmental Research and Public Health. 2013; 10(9): 3834-3842. DOI:10.3390/ijerph10093834
7. Abramson JS. Anti-CD19 CAR T-cell therapy for B-cell non-hodgkin lymphoma. Transfusion Medicine Reviews. 2020; 34(1): 29-33. doi:10.1016/j.tmrv.2019.08.003




