2023.02.03
悬浮细胞应用十分广泛,如免疫学和血液学中的生物测定开发、药理学分析和化合物筛选,都依赖于悬浮细胞的使用。在实验室中,我们通常使用基于离心的方法对悬浮细胞进行若干洗涤步骤,以此去除细胞上过量的未结合抗体或标记试剂。但是随着高通量筛选的流行,当有大量的样本需要处理时,这种手动的操作不仅费时费力,而且容易导致细胞损失。
那么,如何才能高效率高质量满足高通量筛选中每日处理数千个样品的需求呢?
微孔板样品处理智能方案C.WASH是一种自动化的高通量方法。它独特的反向离心方式,使它可以模拟人工拍板轻柔地去除细胞培养基或洗涤缓冲液,清除整个96和384微孔板只需数秒时间,轻松满足高通量筛选的速度要求。不仅如此,它还具有无接触液体分配模块,无需使用针头或移液枪头即可以完成注液,不仅避免传统Tip-based washer引起的交叉污染问题,也可避免传统方法对细胞的损伤。这些优势使C.WASH为单细胞测序、流式细胞术、质谱流式等细胞分析实验提供高一致性的可重复的优良结果。
以下,我们来展示C.WASH在96孔MTP微孔板中洗涤悬浮细胞的一个应用。在本次实验中,我们使用C.WASH和手动清洗两个不同方案,评估了不同形态细胞,如细胞活态、固定态和渗透态细胞的损失(图1)。
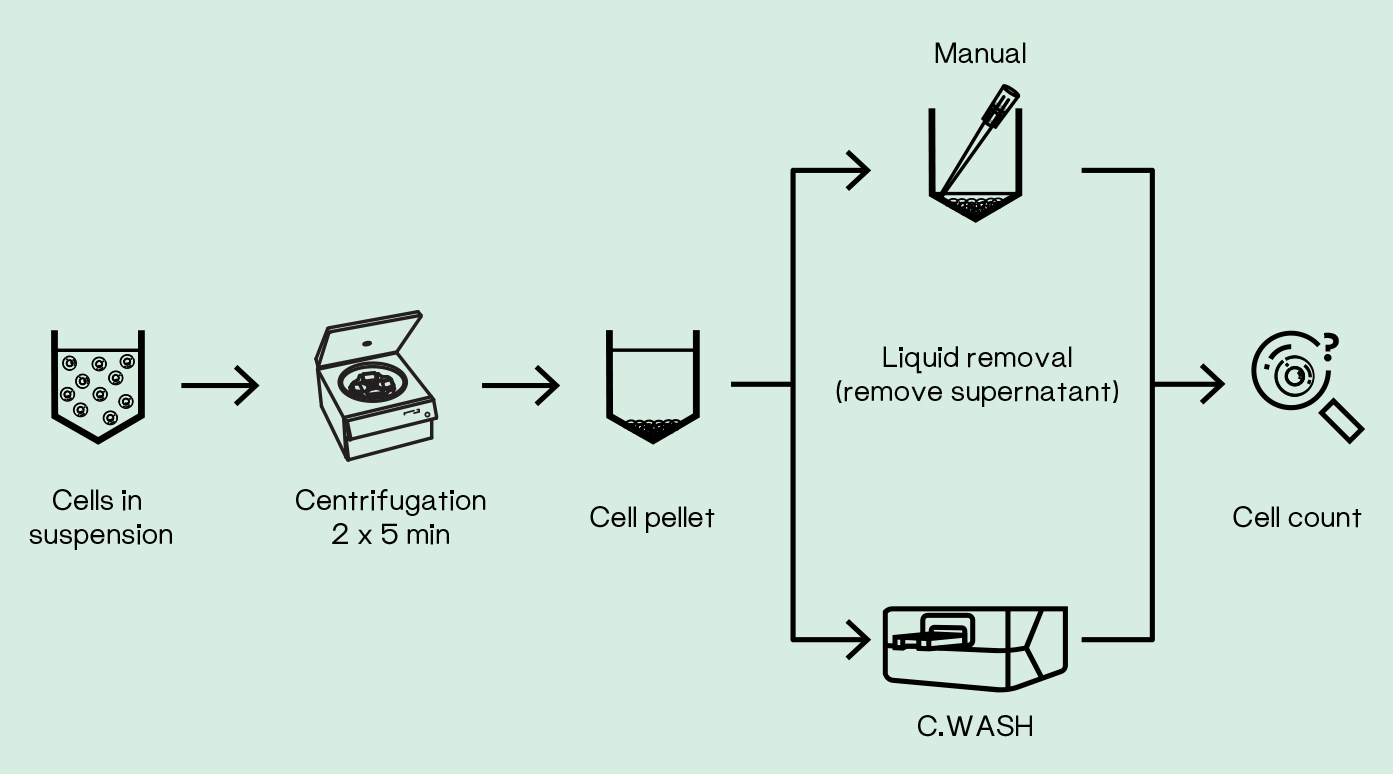
图1.C.WASH和手动操作流程比较
C.WASH清洗悬浮细胞应用
1. 活细胞的清洗
使用CellTiter Glo测量96孔板中每个孔活性细胞的数量,确定Jurkat细胞适合用于测定细胞损失。接着,将Jurkat细胞接种到96孔V型底板中,每孔106个细胞,并进行两轮离心。然后使用C.WASH或手动清洗方法移除上清,比较两种不同方案中细胞的损失情况。
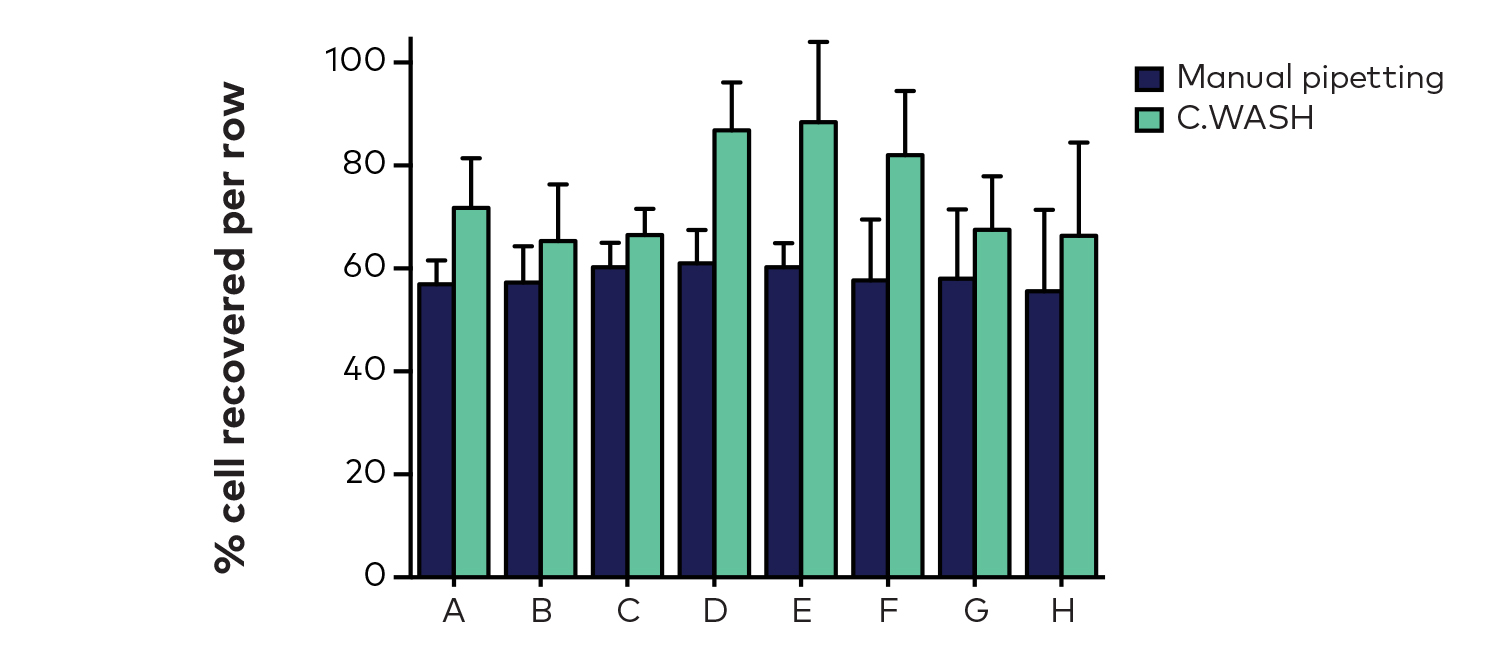
图2.手动和C.WASH清洗后的平均细胞回收率,每个条形代表对应行的12个孔的平均值和标准偏差
结果显示,手动清洗组微孔板上平均细胞回收率为58%,C.WASH组平均细胞回收率为74%(图2)。这说明,C.WASH适用于清洗悬浮细胞,并显著缩短了实验时间,因为C.WASH移除整个板的液体在5秒内就可以完成。
2. 固定和渗透细胞的清洗
细胞接种后,使用离心法收集细胞,并将其重新悬浮在50µL福尔马林中进行固定。洗涤步骤中的液体排空采用C.WASH或手动进。洗涤样本时采用C.WASH或手动操作将孔板中的液体排空。最后使用流式细胞术评估固定和渗透样品的细胞回收率。
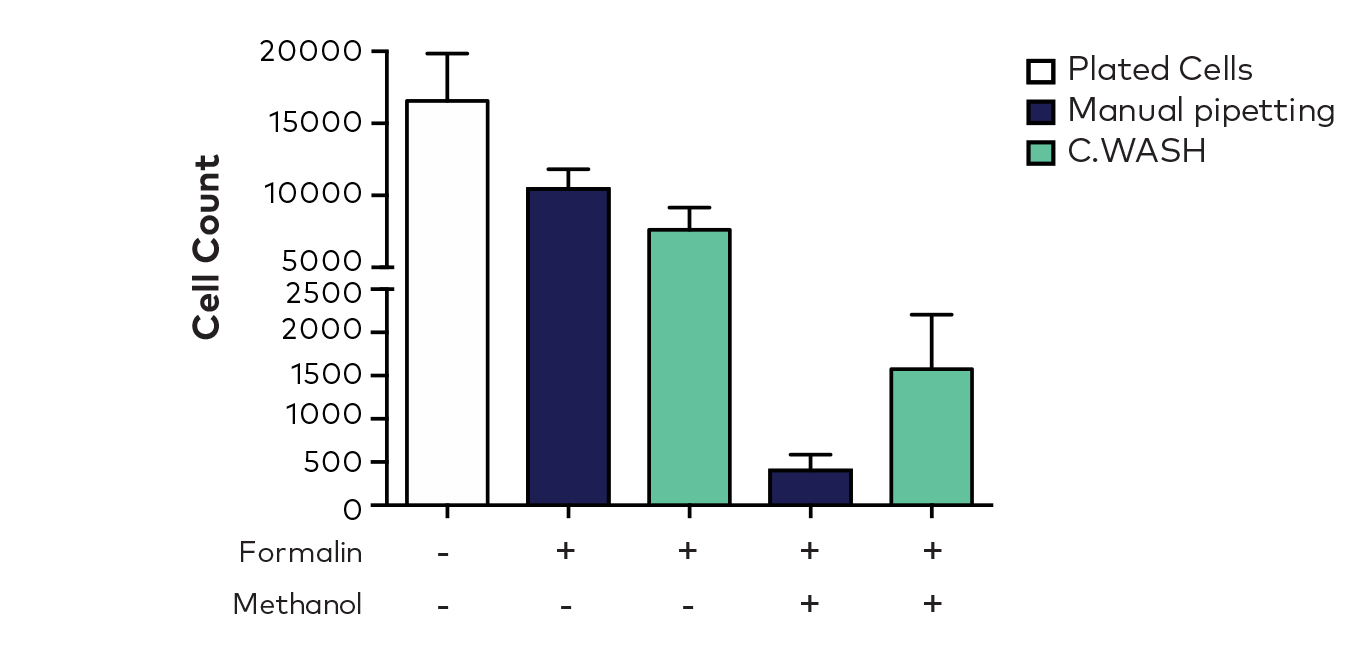
图3.细胞固定或细胞渗透后的计数,每个条形代表整个96孔板的平均细胞计数(+标准偏差)
结果显示,对于固定和渗透的细胞,C.WASH和手动清洗两种方案的细胞回收率相当(图3),但观察到使用C.WASH比手动去除固定和渗透细胞的液体后细胞损失减少。这说明,C.WASH能够在减少手动处理时间和不一致性的同时,提高悬浮细胞的细胞回收率。这个实验可以说明,C.WASH可以替代繁琐的人工操作,可靠地清洗微量滴定板中的悬浮细胞。
C.WASH在悬浮细胞中的主要优势
1. 速度快,节省时间
数秒即可自动去除整个 96 孔板和384 孔板上的液体,缩短整个项目周期。
2.优异的清洗效果
清洗后微孔板内液体残留少(<0.1μL),因此减少所需的清洗循环次数,提升检测的速度和可复现性。
3.节省实验成本
采用非接触式注液,反向离心方式移除清洗液,减少细胞损坏和交叉污染风险,也可以节省移液枪头。




